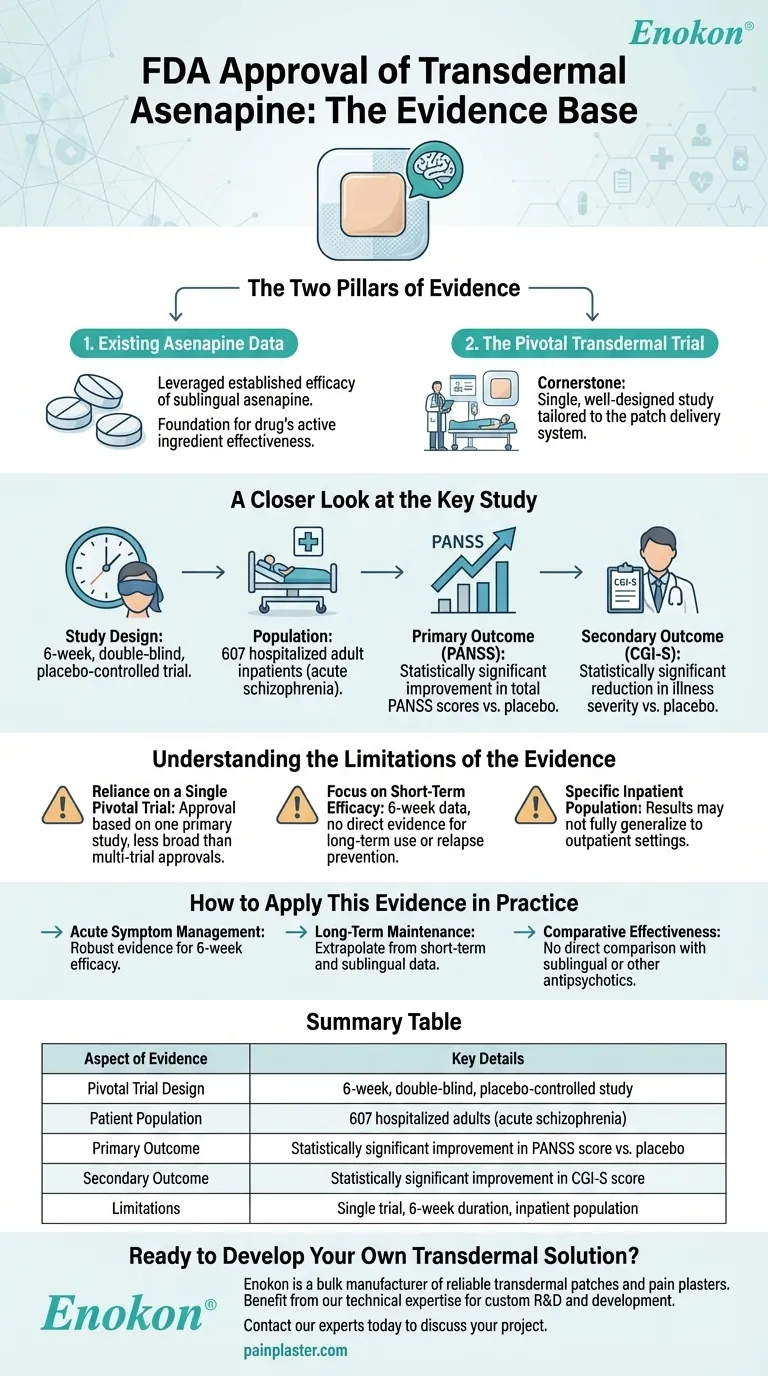
Die FDA-Zulassung für das Asenapin-Pflaster (transdermales Asenapin) wurde durch eine Kombination früherer Wirksamkeitsdaten aus Studien mit sublingualem Asenapin und einer entscheidenden 6-wöchigen, doppelblinden, placebokontrollierten Studie mit 607 erwachsenen stationären Patienten mit Schizophrenie unterstützt.Die transdermale Formulierung zeigte im Vergleich zu Placebo statistisch signifikante Verbesserungen sowohl bei den primären (PANSS-Scores) als auch bei den sekundären Endpunkten (CGI-S-Bewertungen) und bestätigte damit ihren therapeutischen Nutzen.Diese Erkenntnisse belegen die Sicherheit, Wirksamkeit und klinische Relevanz des Pflasters für die Behandlung von Schizophrenie.
Die wichtigsten Punkte werden erklärt:
-
Frühere Daten zur Wirksamkeit von sublingualem Asenapin
- Frühere Studien zur Bewertung von sublingualem Asenapin lieferten grundlegende Erkenntnisse über den Wirkmechanismus und das therapeutische Potenzial des Medikaments bei Schizophrenie.
- Diese Studien lieferten wahrscheinlich Informationen über die Dosierung, das Sicherheitsprofil und die erwarteten Ergebnisse der transdermalen Formulierung und erleichterten so den Zulassungsprozess.
-
Pivotale 6-Wochen-Doppelblind-Studie
- Studien-Design:Eine strenge, placebokontrollierte Studie mit 607 Teilnehmern gewährleistete eine robuste statistische Aussagekraft und minimierte die Verzerrungen.
- Bevölkerung:Die Studie konzentriert sich auf erwachsene stationäre Patienten mit Schizophrenie und spiegelt die Zielgruppe für die klinische Anwendung wider.
- Dauer:Der 6-wöchige Zeitrahmen bot ein ausgewogenes Verhältnis zwischen akuter Symptombeurteilung und praktischer klinischer Anwendbarkeit.
-
Primärer Endpunkt:PANSS-Werte
- Die Positiv- und Negativ-Syndrom-Skala (PANSS) ist ein Goldstandard für die Bewertung der Schwere der Schizophrenie-Symptome.
- Statistisch signifikante Verbesserungen der PANSS-Werte bestätigten die Wirksamkeit des Pflasters bei der Reduzierung sowohl positiver (z. B. Halluzinationen) als auch negativer (z. B. sozialer Rückzug) Symptome.
-
Sekundärer Endpunkt:CGI-S-Bewertungen
- Die Skala "Clinical Global Impression-Severity" (CGI-S) lieferte eine von Klinikern berichtete Validierung der Symptomverbesserung.
- Die Signifikanz untermauerte hier den patientenbezogenen und beobachtbaren klinischen Nutzen.
-
Sicherheit und Verträglichkeit
- Die FDA-Zulassung impliziert, dass die transdermale Formulierung die Sicherheitsanforderungen erfüllt, was wahrscheinlich auf die Daten aus der sublingualen Verabreichung und die Berichte über unerwünschte Ereignisse in den neuen Studien zurückzuführen ist, auch wenn dies in den Referenzen nicht ausdrücklich erwähnt wird.
- Die transdermale Verabreichung bietet möglicherweise Vorteile wie geringere systemische Nebenwirkungen (z. B. im Vergleich zur oralen oder injizierbaren Verabreichung).
-
Regulatorische Begründung
- Die Entscheidung der FDA hing von der reproduzierbaren Wirksamkeit (PANSS/CGI-S) und einem klaren Nutzen-Risiko-Profil ab, das durch kontrollierte Studiendaten gestützt wurde.
- Die Vorteile des Pflasters in Bezug auf Bequemlichkeit und Therapietreue (z. B. verzögerte Freisetzung, nicht-oraler Verabreichungsweg) könnten die Zulassung für eine Bevölkerungsgruppe, die häufig Probleme mit der Therapietreue hat, zusätzlich gerechtfertigt haben.
Für die Einkäufer des Gesundheitswesens unterstreicht dieser Nachweis die Asenapin-Pflaster als eine praktikable, evidenzbasierte Option für die Behandlung von Schizophrenie mit potenziellen Vorteilen bei der Verabreichung und Verträglichkeit.Würde das transdermale Format mit den Bedürfnissen Ihrer Patienten oder den institutionellen Protokollen übereinstimmen?
Zusammenfassende Tabelle:
| Schlüsselnachweise für die FDA-Zulassung | Einzelheiten |
|---|---|
| Frühere Daten zu sublingualem Asenapin | Bekannter Wirkmechanismus und Sicherheitsprofil |
| Pivotale 6-Wochen-Studie | 607 erwachsene stationäre Patienten mit Schizophrenie, doppelblind, placebokontrolliert |
| Primärer Endpunkt (PANSS-Scores) | Statistisch signifikante Symptomreduktion |
| Sekundärer Endpunkt (CGI-S-Bewertungen) | Vom Kliniker bestätigte Verbesserung des Schweregrads |
| Sicherheit & Verträglichkeit | Erfüllt die FDA-Benchmarks, potenzielle Vorteile bei der Adhärenz |
| Regulatorische Begründung | Reproduzierbare Wirksamkeit und klares Nutzen-Risiko-Profil |
Sind Sie daran interessiert, transdermales Asenapin in Ihre Behandlungsprotokolle zu integrieren?
Wir sind ein zuverlässiger Hersteller von transdermalen Pflastern und Schmerzpflastern, Enokon bietet zuverlässige, klinisch validierte Lösungen für Vertriebsunternehmen im Gesundheitswesen und pharmazeutische Marken.Unser Fachwissen in der kundenspezifischen Forschung und Entwicklung gewährleistet Formulierungen, die auf die Bedürfnisse Ihrer Patienten zugeschnitten sind.
Kontaktieren Sie uns noch heute um Partnerschaftsmöglichkeiten zu besprechen oder Produktmuster anzufordern.
Visuelle Anleitung
Ähnliche Produkte
- Asthma-Husten- und Schmerzlinderungspflaster für Erwachsene und Kinder
- Menthol Gel Schmerzlinderungspflaster
- Icy Hot Menthol Medizin Schmerzlinderung Patch
- Far Infrared Deep Heat Relief Patches Medizinische Schmerzpflaster
- Herbal Eye Protection Patch Augenpflaster
Andere fragen auch
- Wie sollte mit einer vergessenen Dosis des Reliever-Pflasters umgegangen werden?Richtlinien zur sicheren Anwendung
- Wie lindert das Hustenpflaster gezielt den Husten?Entdecken Sie die Wissenschaft hinter der lokalisierten Linderung
- Sind Schmerzlinderungspflaster für empfindliche Haut sicher?Wie man sie sicher verwendet
- Wie funktioniert die Ferninfrarot-Technologie im Hustenpflaster?Entdecken Sie die tiefgreifende Linderung
- Wie wirkt Capsaicin im Reliever Patch?Eine arzneimittelfreie Lösung für gezielte Schmerzlinderung















