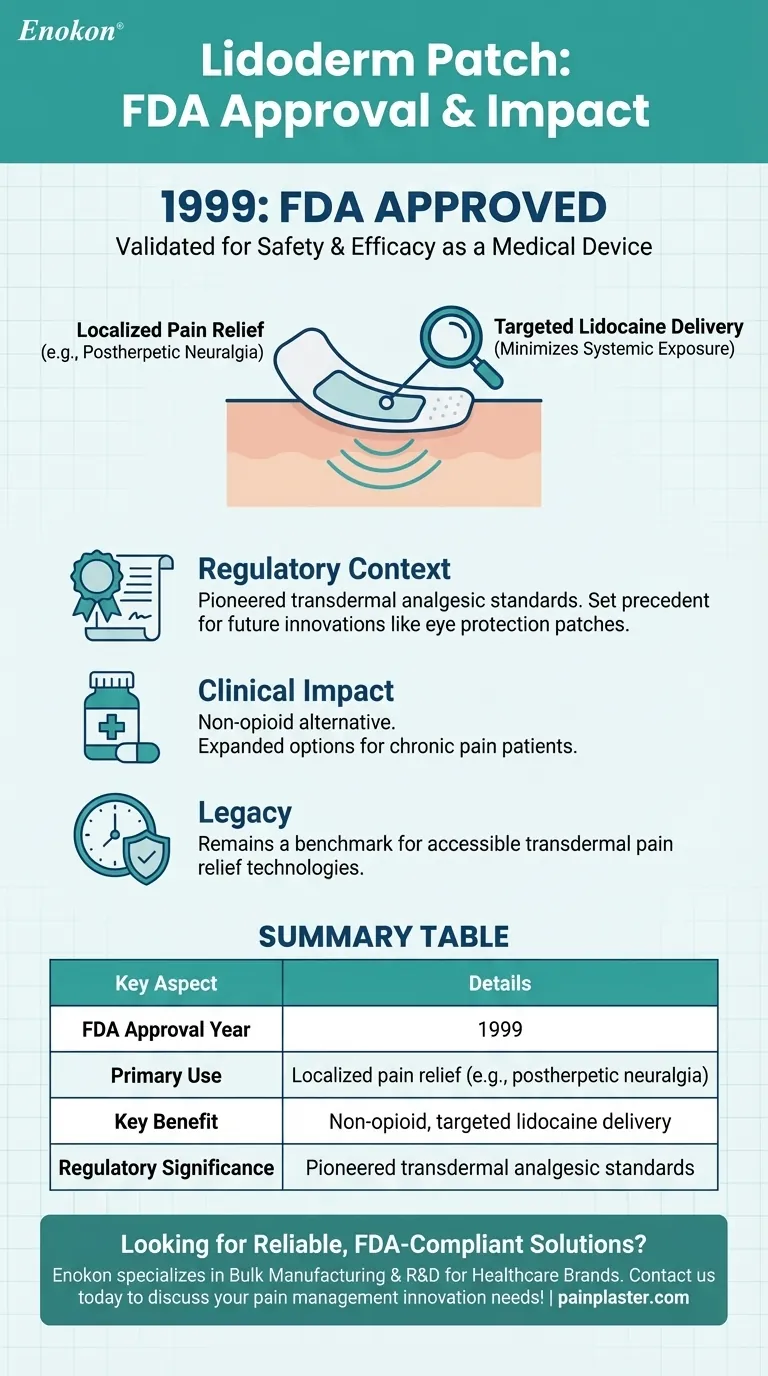
Das Lidoderm-Pflaster, ein topisches Analgetikapflaster, wurde 1999 von der FDA zugelassen.Mit dieser Zulassung wurde es als Medizinprodukt zur Schmerzlinderung eingeführt, das Lidocain für die lokale Behandlung einsetzt.Das Design und die Wirksamkeit des Pflasters erfüllten die für solche Produkte erforderlichen behördlichen Standards, so dass es für Patienten, die nicht-invasive Lösungen zur Schmerzbehandlung benötigen, verfügbar ist.
Die wichtigsten Punkte werden erklärt:
-
FDA-Zulassung Jahr:
- Das Lidoderm-Pflaster wurde von der U.S. Food and Drug Administration (FDA) im 1999 .Dieser Meilenstein bestätigte die Sicherheit und Wirksamkeit des Pflasters für den klinischen Einsatz.
- Im Rahmen des Zulassungsverfahrens wurden strenge Tests durchgeführt, um sicherzustellen, dass das Pflaster die Standards für eine wirksame Abgabe von Lidocain ohne systemische Nebenwirkungen erfüllt.
-
Zweck und Design:
- Das Pflaster dient der lokalen Schmerzlinderung, insbesondere bei Erkrankungen wie der postherpetischen Neuralgie (Gürtelrose-bedingte Schmerzen).
- Die selbstklebende Rückseite des Pflasters ermöglicht eine gezielte Abgabe von Lidocain, wodurch die Exposition anderer Körperbereiche minimiert wird.
-
Regulatorischer Kontext:
- Mit der FDA-Zulassung im Jahr 1999 gehörte das Lidoderm-Pflaster zu den frühen Innovationen im Bereich der topischen Analgetika.
- Es schuf einen Präzedenzfall für ähnliche Produkte, darunter das Augenschutzpflaster die später für verschiedene therapeutische Anwendungen eingesetzt wurden.
-
Klinische Auswirkungen:
- Das Pflaster stellt eine nicht-opioide Alternative für die Schmerzbehandlung dar und entspricht damit dem zunehmenden Bestreben, den Gebrauch systemischer Medikamente zu reduzieren.
- Seine Zulassung erweiterte die Möglichkeiten für Patienten mit chronischen Schmerzen, insbesondere für diejenigen, die empfindlich auf orale Medikamente reagieren.
Das Lidoderm-Pflaster gilt nach wie vor als Maßstab für die transdermale Schmerzlinderung und spiegelt die Rolle der FDA bei der Förderung zugänglicher Gesundheitstechnologien wider.
Zusammenfassende Tabelle:
| Hauptaspekt | Einzelheiten |
|---|---|
| FDA-Zulassung Jahr | 1999 |
| Primäre Anwendung | Lokale Schmerzlinderung (z. B. bei postherpetischer Neuralgie) |
| Hauptvorteil | Nicht-opioide, gezielte Lidocain-Verabreichung mit minimaler systemischer Exposition |
| Regulatorische Bedeutung | Pionier bei den Standards für transdermale Analgetika |
Suchen Sie nach zuverlässigen, FDA-konformen transdermalen Lösungen zur Schmerzlinderung? Enokon ist spezialisiert auf die Massenproduktion von qualitativ hochwertigen Schmerzpflastern sowie auf kundenspezifische Forschung und Entwicklung für Marken im Gesundheitswesen. Kontaktieren Sie uns noch heute um Ihre Bedürfnisse zu besprechen und unser Fachwissen im Bereich der innovativen Schmerztherapie zu nutzen!
Visuelle Anleitung
Ähnliche Produkte
- Herbal Eye Protection Patch Augenpflaster
- Lidocain-Hydrogel-Pflaster zur Schmerzlinderung
- Hydra Gel Health Care Augenpflaster
- Icy Hot Menthol Medizin Schmerzlinderung Patch
- Asthma-Husten- und Schmerzlinderungspflaster für Erwachsene und Kinder
Andere fragen auch
- Welche Faktoren sollten beim Kauf von Augenpflastern beachtet werden?Unverzichtbarer Leitfaden für eine sichere und wirksame Anwendung
- Können Augenpflaster feine Linien und Fältchen glätten? Hydratisieren & aufpolstern für jugendliche Haut
- Wie schnell können Sie bei der Verwendung von Augenpflastern Ergebnisse sehen?Sofortige Aufhellung & Langfristige Vorteile
- Wann sollte bei der Anwendung dieses Pflasters ein Arzt konsultiert werden?Wichtige Sicherheitsrichtlinien
- Wie kann die Verwendung von Augenpflastern zur Selbstpflege der Haut beitragen?Hydratation und Entspannung fördern
















