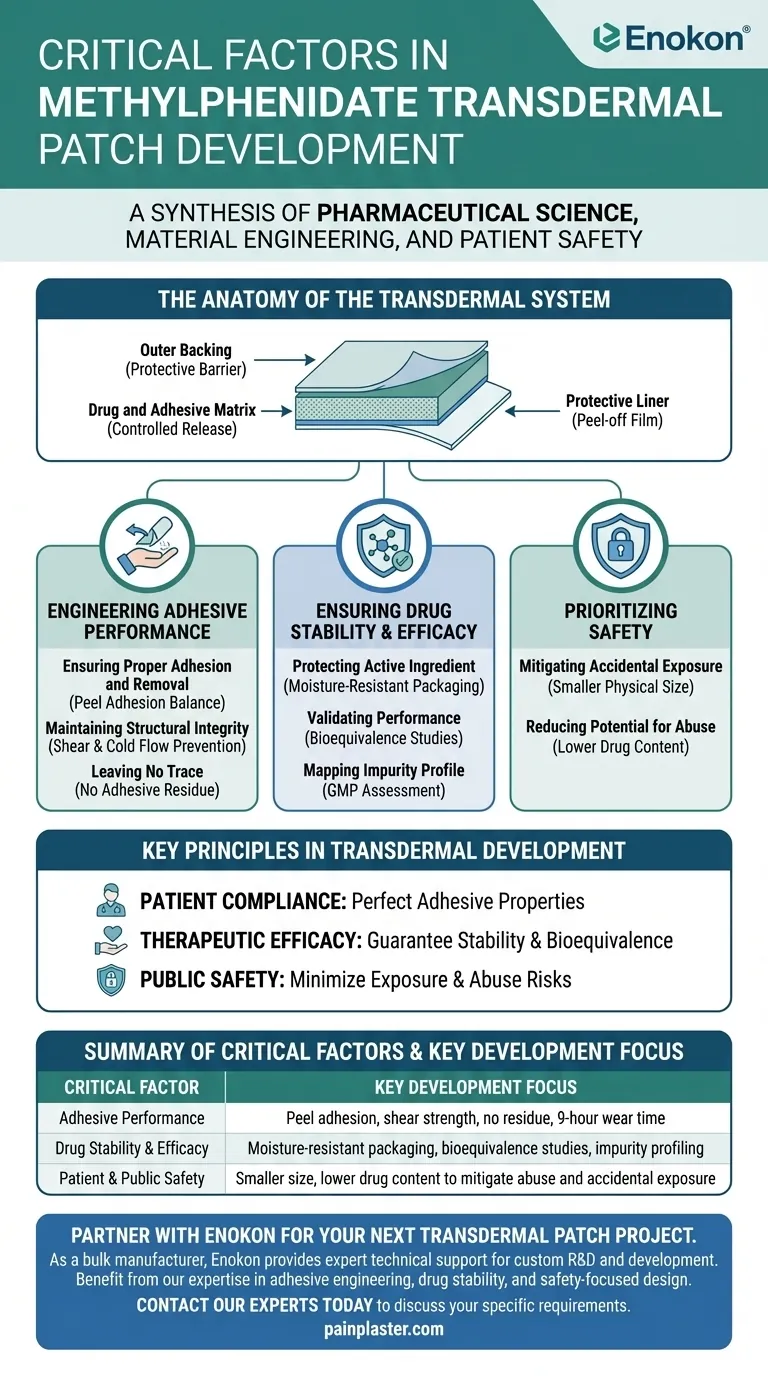
Die Entwicklung des Methylphenidat transdermalen Pflasters erforderte eine sorgfältige Abwägung von pharmazeutischer Wissenschaft, Materialtechnik und Einhaltung gesetzlicher Vorschriften.Zu den kritischen Faktoren gehörten die Optimierung der Klebeeigenschaften für eine konsistente Medikamentenabgabe und Hauthaftung, die Gewährleistung der chemischen Stabilität durch spezielle Verpackungen und die Minimierung des Missbrauchspotenzials durch Größe und Dosierung.Strenge Prüfprotokolle validierten die Leistung unter Einhaltung der Guten Herstellungspraxis, während bei der Auswahl der Komponenten (wie Trennfolien und Penetrationsverstärker) sowohl die Wirksamkeit als auch die Sicherheit berücksichtigt wurden.All diese Überlegungen zielten darauf ab, eine zuverlässige, patientenfreundliche Darreichungsform zu schaffen, die den therapeutischen Nutzen bewahrt und gleichzeitig Risiken wie Abbau oder versehentliche Exposition minimiert.

Schlüsselpunkte erklärt:
-
Optimierung des Klebesystems
- Schälhaftung/Scherprüfung :Es wurde sichergestellt, dass das Pflaster sicher befestigt bleibt, ohne Hautreizungen zu verursachen oder Rückstände zu hinterlassen.Parameter wie die Ablösekraft des Pflasters wurden für eine einfache Anbringung/Entfernung kalibriert.
- Verhinderung von Kaltfluss :Die Migration des Klebstoffs, die die Medikamentenabgabe oder die Integrität des Pflasters im Laufe der Zeit beeinträchtigen könnte.
-
Medikamentenformulierung und -stabilität
- Geringerer Wirkstoffgehalt :Reduzierte Methylphenidat-Konzentration zur Minimierung des Missbrauchspotenzials bei gleichbleibender Wirksamkeit.
- Feuchtigkeitsresistente Verpackung :Schutz des Arzneimittels vor Hydrolyse oder Abbau, was bei einem Produkt, das der Hautfeuchtigkeit ausgesetzt ist, von entscheidender Bedeutung ist.
-
Komponentendesign für Sicherheit
- Kleinere Patch-Größe :Verringerung des Risikos einer versehentlichen Exposition (z. B. durch Kinder) und verbesserte Tragbarkeit.
- Mehrschichtige Struktur :Trägerschichten und Membranen kontrollierten die Freisetzungsrate von Medikamenten, während Penetrationsverstärker die Bioverfügbarkeit optimierten.
-
Regulatorische & klinische Validierung
- Stabilitäts-/Verunreinigungsstudien :Sicherstellung der Einhaltung der ICH-Richtlinien unter unterschiedlichen Temperatur- und Feuchtigkeitsbedingungen.
- Bioäquivalenz-Prüfungen :Klinische pharmakokinetische Studien bestätigten eine konsistente Arzneimittelabsorption im Vergleich zu oralen Formulierungen.
-
Herstellungskontrollen
- GMP-Einhaltung :Einhaltung strenger Produktionsstandards für Reproduzierbarkeit, von der Klebstoffmischung bis zur Endverpackung.
Wussten Sie schon? Das Design des Pflasters spiegelt einen breiteren Trend in der transdermalen Technologie wider, bei der Innovationen in der Materialwissenschaft eine präzise, lang anhaltende Verabreichung von Medikamenten für Krankheiten wie ADHS ermöglichen.
Zusammenfassende Tabelle:
| Faktor | Wichtige Überlegungen |
|---|---|
| Klebesystem | Schälhaftung, Schertest, Kaltflussverhinderung für sichere Befestigung und Integrität. |
| Medikamentenformulierung | Geringerer Wirkstoffgehalt zur Sicherheit, feuchtigkeitsresistente Verpackung zur Verhinderung von Zersetzung. |
| Sicheres Design | Kleinere Pflastergröße, mehrschichtige Struktur für kontrollierte Freisetzung und Tragbarkeit. |
| Einhaltung gesetzlicher Vorschriften | Stabilitäts-/Reinheitsprüfungen, Bioäquivalenzstudien, GMP-Herstellungsstandards. |
Sie benötigen eine zuverlässige Lösung für transdermale Pflaster? Partner mit Enokon ist ein zuverlässiger Großhersteller von präzisionsgefertigten transdermalen Pflastern und Schmerzpflastern.Unser Fachwissen in Bezug auf Klebstoffe in pharmazeutischer Qualität, kundenspezifische Formulierung und vorschriftsgemäße Produktion gewährleistet, dass Ihr Produkt die Wirksamkeits- und Sicherheitsstandards erfüllt. Kontaktieren Sie uns noch heute um Ihre Projektanforderungen zu besprechen!
Visuelle Anleitung
Ähnliche Produkte
- Icy Hot Menthol Medizin Schmerzlinderung Patch
- Beifuß-Wermut-Pflaster zur Schmerzlinderung bei Nackenschmerzen
- Ferninfrarot-Wärmepflaster zur Schmerzlinderung Transdermale Pflaster
- Capsaicin-Chili-Pflaster zur medizinischen Schmerzlinderung
- Menthol Gel Schmerzlinderungspflaster
Andere fragen auch
- Sind Kühlpflaster wiederverwendbar?Verständnis von Single-Use-Kühllösungen
- Welche wichtigen Warnhinweise gibt es bei der Anwendung von Menthol zur äußerlichen Anwendung? Sicherheitstipps für eine wirksame Schmerzlinderung
- Wie wirkt Menthol im Reliever Patch?Schmerzlinderung mit doppelter Wirkung erklärt
- Wie funktioniert Menthol als örtliches Schmerzmittel?Die Wissenschaft hinter der kühlenden Schmerzlinderung
- Wie wirkt das Menthol im Pflaster gegen Schmerzen?Entdecken Sie die Wissenschaft hinter der schnell wirkenden Linderung













