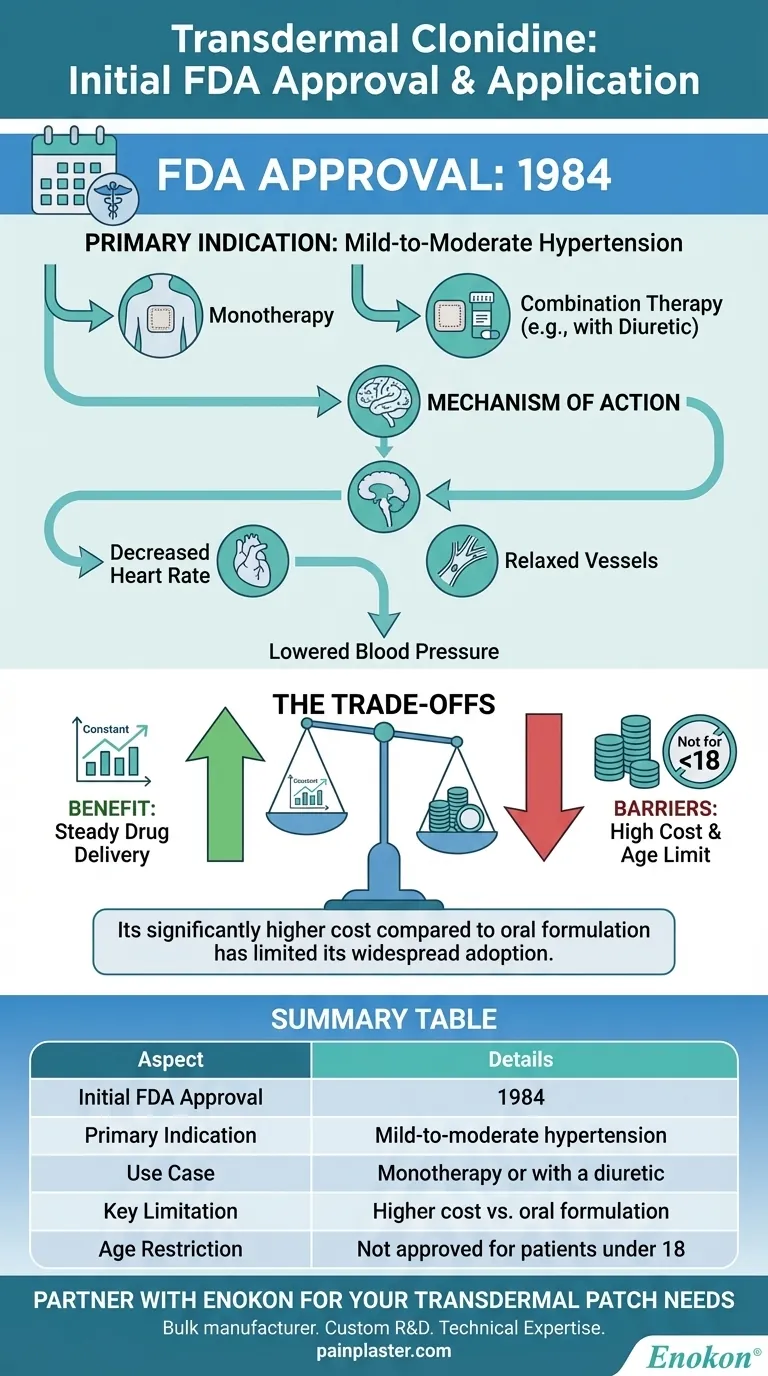
Transdermales Clonidin wurde erstmals 1984 von der US-amerikanischen Food and Drug Administration (FDA) für die Behandlung von leichtem bis mittelschwerem Bluthochdruck zugelassen, entweder als alleinige Therapie oder in Kombination mit einem Diuretikum.Mit dieser Zulassung wurde eine neuartige Verabreichungsmethode für Clonidin eingeführt, die dessen Fähigkeit zur Senkung des Blutdrucks über zentrale Alpha-Agonisten-Mechanismen nutzte.Das transdermale Pflaster bot Vorteile wie eine anhaltende Wirkstofffreisetzung und eine verbesserte Therapietreue der Patienten, was es damals zu einem bedeutenden Fortschritt in der Behandlung von Bluthochdruck machte.
Die wichtigsten Punkte werden erklärt:
-
Erste FDA-Zulassung (1984)
- Das transdermale Clonidin-Pflaster erhielt 1984 die FDA-Zulassung speziell für die Behandlung von leichtem bis mittelschwerem Bluthochdruck.
- Diese Zulassung bestätigte die Wirksamkeit des Pflasters als Monotherapie oder als Ergänzung zu Diuretika und deckte damit den dringenden Bedarf an lang wirkenden blutdrucksenkenden Mitteln.
-
Primäre Indikation:Bluthochdruck
-
Das Pflaster wurde entwickelt, um eine kontinuierliche Clonidinabgabe zu gewährleisten und den Blutdruck zu senken:
- Senkung der Herzfrequenz.
- Entspannung der Blutgefäße zur Verbesserung der Durchblutung.
- Seine Einstufung als zentral wirkender Alpha-Agonist als blutdrucksenkendes Mittel unterstreicht seinen Wirkmechanismus im Hirnstamm zur Modulation des Sympathikusausflusses.
-
Das Pflaster wurde entwickelt, um eine kontinuierliche Clonidinabgabe zu gewährleisten und den Blutdruck zu senken:
-
Vorteile der transdermalen Verabreichung
- Im Gegensatz zu oralen Formulierungen gewährleistet das Pflaster einen konstanten Wirkstoffspiegel und minimiert die Schwankungen zwischen Spitzen- und Durchschnittswerten.
- Eine geringere Dosierungshäufigkeit (z. B. wöchentliche Anwendung) verbesserte die Adhärenz, insbesondere bei chronischen Erkrankungen wie Bluthochdruck.
-
Altersbeschränkungen
- Insbesondere die transdermale Form wurde nicht für Patienten unter 18 Jahren zugelassen, was auf die damals begrenzten Sicherheitsdaten in pädiatrischen Bevölkerungsgruppen zurückzuführen war.
-
Historischer Kontext
- Die Zulassung von 1984 stellte eine Innovation bei der Verabreichung von Arzneimitteln dar und entsprach dem allgemeinen Trend zu nicht-oralen Therapien für Herz-Kreislauf-Erkrankungen.
- Es ergänzte das bereits vorhandene orale Clonidin und bot eine Alternative für Patienten mit gastrointestinalen Verträglichkeitsproblemen.
Das transdermale Clonidinpflaster ist ein Beweis dafür, wie zielgerichtete Arzneimittelabgabesysteme die Behandlung chronischer Krankheiten verändern können - eine leise Optimierung der Therapie durch hautnahe Wissenschaft.
Zusammenfassende Tabelle:
| Hauptaspekt | Einzelheiten |
|---|---|
| FDA-Zulassung Jahr | 1984 |
| Primäre Indikation | Leichter bis mittelschwerer Bluthochdruck (Monotherapie oder in Kombination mit Diuretika) |
| Mechanismus der Wirkung | Zentral wirkender Alpha-Agonist, reduziert den Sympathikusausfluss |
| Wesentliche Vorteile | Kontinuierliche Wirkstofffreisetzung, verbesserte Compliance, wöchentliche Dosierung |
| Altersbeschränkungen | Nicht zugelassen für Patienten unter 18 Jahren |
Benötigen Sie zuverlässige transdermale Lösungen für Bluthochdruck oder chronische Schmerzen?
Enokon ist auf hochwertige transdermale Pflaster spezialisiert und kombiniert jahrzehntelange Erfahrung mit anpassbarer Forschung und Entwicklung für pharmazeutische Marken und Händler.
Kontaktieren Sie uns noch heute
um Ihr Projekt zu besprechen - lassen Sie uns gemeinsam innovativ sein!
Visuelle Anleitung
Ähnliche Produkte
- Ferninfrarot-Wärmepflaster zur Schmerzlinderung Transdermale Pflaster
- Wärmepflaster zur Schmerzlinderung bei Menstruationskrämpfen
- Far Infrared Deep Heat Relief Patches Medizinische Schmerzpflaster
- Herbal Eye Protection Patch Augenpflaster
- Menthol Gel Schmerzlinderungspflaster
Andere fragen auch
- Wie schnell wird das Deep Heat Pain Relief Back Patch aktiviert und wie lange hält die Wärme an?Schnelle & langanhaltende Linderung
- Was hat die britische Million Women Study über die transdermale gegenüber der oralen Hormontherapie ergeben?
- Wie wirken Wärmepflaster zur Schmerzlinderung?Gezielte Wärmetherapie für dauerhaften Komfort
- Wie funktioniert das Deep Heat Pain Relief Back Patch?Arzneimittelfreie Schmerzlinderung mit therapeutischer Wärme
- Was sind die Hauptmerkmale des Deep Heat Pain Relief Back Patch?Arzneimittelfreie, lang anhaltende Linderung
















