Transdermale Pflaster, einschließlich Mikronadelpflaster (MNP), werden in den USA als Kombinationsprodukte von der FDA reguliert, was strenge Zulassungsverfahren erfordert, um Sicherheit und Wirksamkeit zu gewährleisten. Diese Produkte enthalten medizintechnische und medikamentöse/biologische Komponenten, die je nach ihrer primären Wirkungsweise die Einhaltung spezifischer Zulassungswege erforderlich machen. Das Zulassungsverfahren umfasst präklinische und klinische Tests, Qualitätskontrollen und die Einhaltung von Kennzeichnungs- und Herstellungsstandards.
Die wichtigsten Punkte erklärt:
-
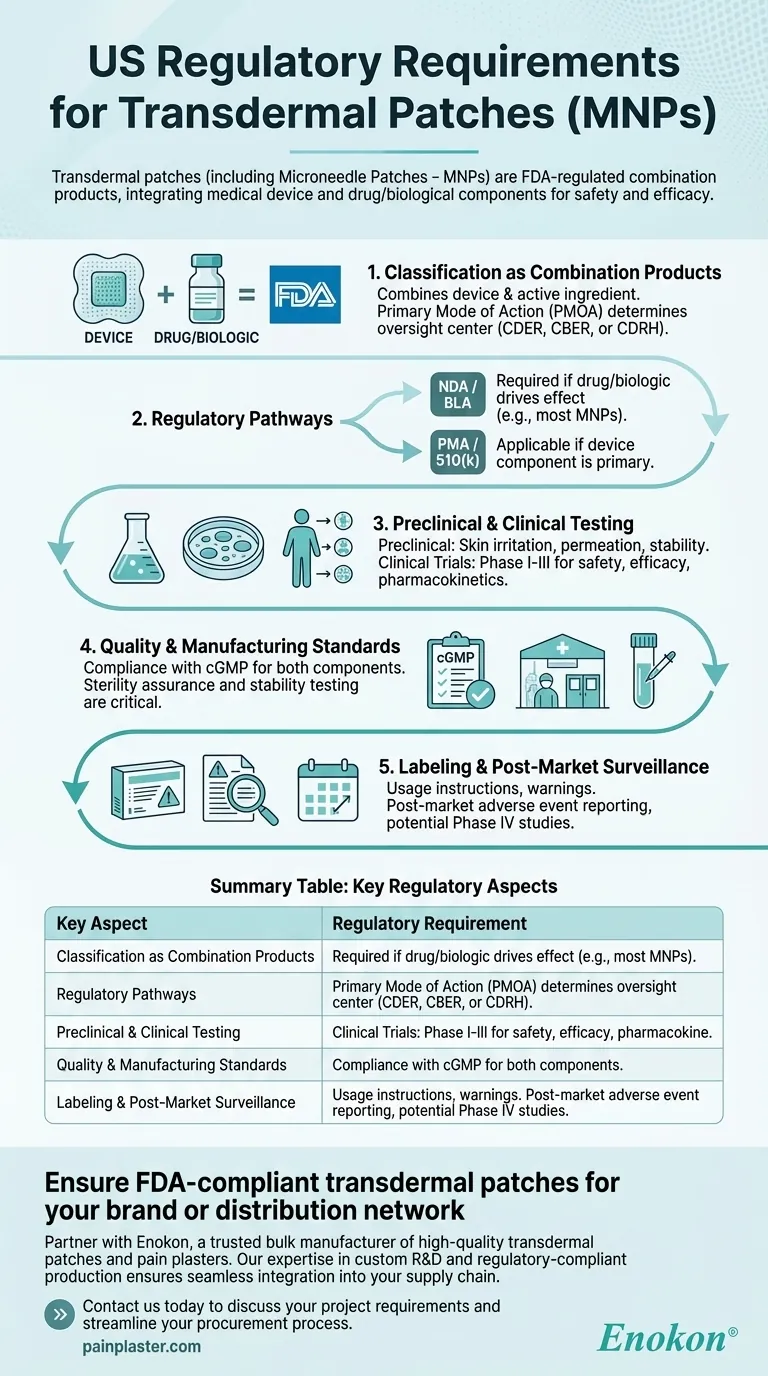
Einstufung als Kombinationsprodukte
- Die FDA kategorisiert transdermale Pflaster als Kombinationsprodukte ein, weil sie ein Medizinprodukt (z. B. Pflasterunterlage, Mikronadeln) mit einem Arzneimittel oder biologischen Wirkstoff kombinieren.
- Die primäre Wirkungsweise (PMOA) bestimmt, ob das Produkt durch das Center for Drug Evaluation and Research (CDER), das Center for Biologics Evaluation and Research (CBER) oder das Center for Devices and Radiological Health (CDRH) reguliert wird.
-
Regulatorische Pfade
- Antrag auf Zulassung eines neuen Arzneimittels (NDA) oder Biologics License Application (BLA): Erforderlich, wenn das Medikament oder die biologische Komponente für die therapeutische Wirkung verantwortlich ist.
- Vormarktzulassung (PMA) oder 510(k): Anwendbar, wenn die Gerätekomponente primär ist (z. B. Mikronadeln, die die Medikamentenverabreichung erleichtern).
- MNPs folgen aufgrund ihrer arzneimittelzentrierten Funktion häufig dem NDA/BLA-Verfahren.
-
Präklinische und klinische Tests
- Präklinische Studien: Dazu gehören Hautreizungs-, Permeations- und Stabilitätstests zur Bewertung der Sicherheit und Effizienz der Verabreichung.
- Klinische Studien: In Phase I-III-Studien werden Pharmakokinetik, Wirksamkeit und unerwünschte Wirkungen am Menschen untersucht.
-
Qualitäts- und Herstellungsstandards
- Einhaltung der Current Good Manufacturing Practices (cGMP) sowohl für Arzneimittel als auch für Produktkomponenten.
- Sterilitätssicherung und Stabilitätstests sind bei Pflastern mit biologischen Wirkstoffen von entscheidender Bedeutung.
-
Kennzeichnung und Überwachung nach dem Inverkehrbringen
- Die Etiketten müssen Gebrauchsanweisungen, Warnhinweise und Lagerungsbedingungen enthalten.
- Zu den Anforderungen nach der Markteinführung gehören die Meldung von unerwünschten Ereignissen und mögliche Phase-IV-Studien.
Für Einkäufer ist es wichtig, diese Anforderungen zu verstehen, um sich mit FDA-konformen Lieferanten abzustimmen und das Risiko nicht konformer Produkte zu verringern. Haben Sie schon darüber nachgedacht, wie sich diese Vorschriften auf Ihre Beschaffungsfristen oder Kriterien für die Lieferantenauswahl auswirken? Das Zusammenspiel von Geräte- und Arzneimittelaufsicht bestimmt die Zuverlässigkeit moderner transdermaler Therapien.
Zusammenfassende Tabelle:
| Hauptaspekt | Regulatorische Anforderung |
|---|---|
| Einstufung | Von der FDA als Kombinationsprodukte (Gerät + Arzneimittel/biologisch) reguliert. |
| Primäre Wirkungsweise | Bestimmt die Aufsicht durch CDER (Arzneimittel), CBER (Biologika) oder CDRH (Produkte). |
| Zulassungspfade | NDA/BLA (arzneimittelgesteuert) oder PMA/510(k) (gerätegesteuert). MNPs folgen in der Regel der NDA/BLA. |
| Testanforderungen | Präklinische (Sicherheit, Permeation) und klinische Versuche (Phasen I-III). |
| Herstellungsstandards | cGMP-Konformität sowohl für Arzneimittel- als auch für Produktkomponenten; Sterilitätsgarantie für biologische Produkte. |
| Verpflichtungen nach der Markteinführung | Berichterstattung über unerwünschte Ereignisse, Phase-IV-Studien und Einhaltung der Etikettierungsvorschriften. |
Sicherstellung FDA-konformer transdermaler Pflaster für Ihre Marke oder Ihr Vertriebsnetz
Partnerschaft mit
Enokon
einem zuverlässigen Hersteller von hochwertigen transdermalen Pflastern und Schmerzpflastern in großen Mengen. Unser Fachwissen in der kundenspezifischen Forschung und Entwicklung sowie in der aufsichtsrechtlich konformen Produktion gewährleistet eine nahtlose Integration in Ihre Lieferkette.
Kontaktieren Sie uns noch heute
um Ihre Projektanforderungen zu besprechen und Ihren Beschaffungsprozess zu rationalisieren.
Visuelle Anleitung
Ähnliche Produkte
- Ferninfrarot-Wärmepflaster zur Schmerzlinderung Transdermale Pflaster
- Wärmepflaster zur Schmerzlinderung bei Menstruationskrämpfen
- Heat Relief Capsicum Patch zur Linderung von Schmerzen im unteren Rückenbereich
- Capsaicin-Chili-Pflaster zur medizinischen Schmerzlinderung
- Medizinische kühlende Gel-Pflaster für Fieber Kühlende Pflaster
Andere fragen auch
- Wie wirken Wärmepflaster zur Schmerzlinderung?Gezielte Wärmetherapie für dauerhaften Komfort
- Was sind die Hauptmerkmale des Deep Heat Pain Relief Back Patch?Arzneimittelfreie, lang anhaltende Linderung
- Wie wirkt Capsaicin in dem Wärmepflaster mit Medikamenten?Die Wissenschaft hinter der Schmerzlinderung
- Können Wärmepflaster bei frischen Verletzungen verwendet werden?Warum Kältetherapie besser wirkt
- Was sind die häufigsten Nebenwirkungen bei der Verwendung von Wärmepflastern mit Medikamenten?Verständnis der Risiken und sichere Anwendung
















