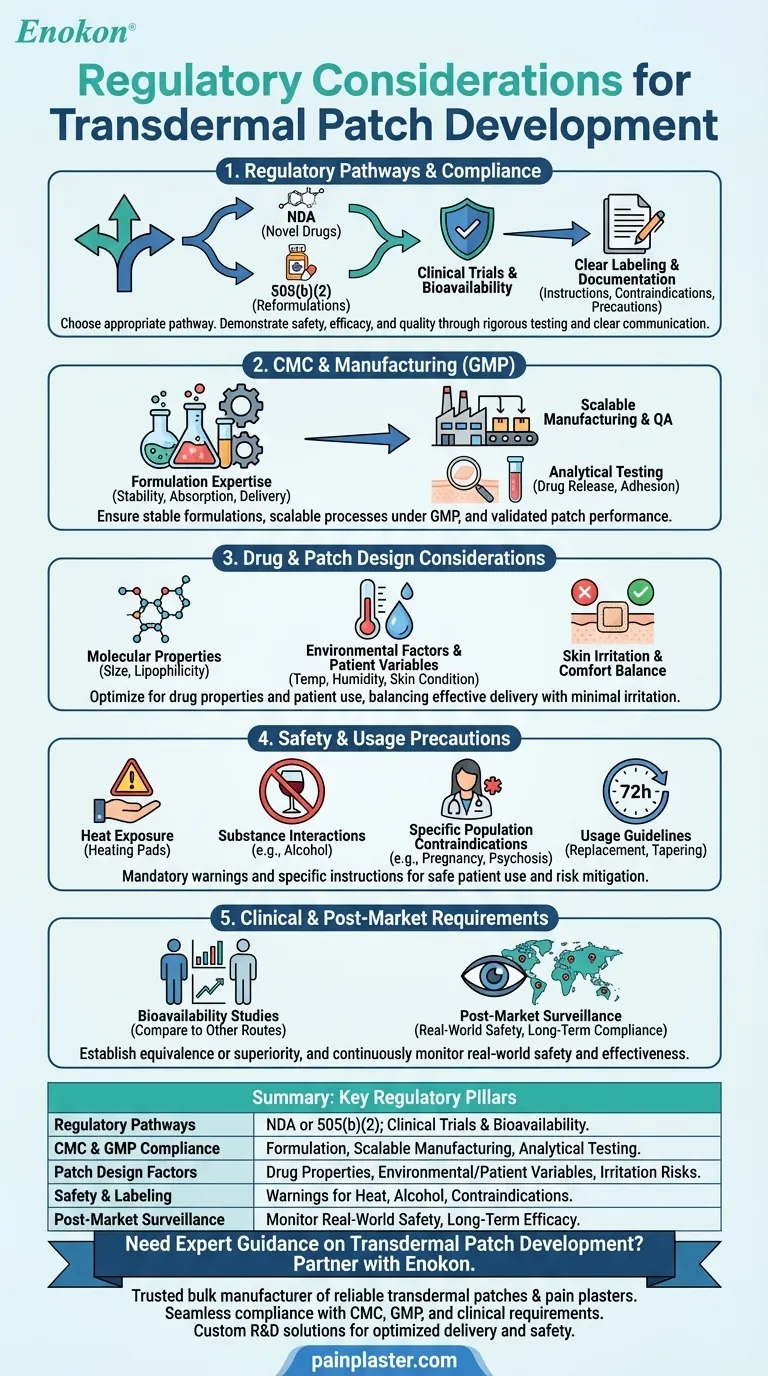
Bei der Entwicklung von transdermalen Pflastern muss man sich in einem komplexen regulatorischen Umfeld bewegen, um Sicherheit, Wirksamkeit und Qualität zu gewährleisten.Zu den wichtigsten Aspekten gehören die Einhaltung der Anforderungen an Chemie, Herstellung und Kontrollen (CMC), die Einhaltung der Guten Herstellungspraxis (GMP) und gründliche klinische Tests für Bioverfügbarkeit und Sicherheit.Bei der Entwicklung von Pflastern müssen die Eigenschaften des Medikaments (z. B. Molekülgröße, Polarität) und Umweltfaktoren berücksichtigt werden, während die Etikettierung und Dokumentation strengen Standards entsprechen muss.Je nach Neuartigkeit des Medikaments können Zulassungswege wie NDAs oder 505(b)(2) zur Anwendung kommen.Vorsichtsmaßnahmen wie das Risiko von Hautreizungen und Anwendungsbeschränkungen (z. B. Vermeidung von Hitzeeinwirkung) müssen ebenfalls berücksichtigt werden, um eine Zulassung zu erhalten und die Sicherheit der Patienten zu gewährleisten.

Die wichtigsten Punkte erklärt:
-
Zulassungswege und Einhaltung der Vorschriften
- Sponsoren müssen zwischen einem Antrag auf Zulassung eines neuen Arzneimittels (NDA) für neuartige Medikamente und einem 505(b)(2)-Pfad für Neuformulierungen von zugelassenen Medikamenten wählen.
- Übereinstimmung mit transdermales Pflaster Vorschriften erfordert den Nachweis von Sicherheit, Wirksamkeit und Qualität durch klinische Studien, einschließlich Bioverfügbarkeitsstudien.
- Klare Etikettierung und Dokumentation sind obligatorisch, mit detaillierten Gebrauchsanweisungen, Kontraindikationen (z. B. demenzbedingte Psychosen) und Vorsichtsmaßnahmen (z. B. Vermeidung von Alkohol oder Hitzeeinwirkung).
-
Chemie, Herstellung und Kontrollen (CMC)
- Das Fachwissen über die Formulierung ist entscheidend, um die Stabilität und Absorption von Arzneimitteln sowie gleichbleibende Verabreichungsraten zu gewährleisten.
- Skalierbarkeit und Qualitätssicherung bei der kommerziellen Herstellung müssen den GMP-Standards entsprechen.
- Analytische Tests validieren die Leistung des Pflasters, einschließlich der Wirkstofffreisetzungsprofile und der Hafteigenschaften.
-
Überlegungen zum Design von Medikamenten und Pflastern
- Molekulare Eigenschaften (z. B. geringe Größe, Lipophilie) beeinflussen die Absorptionsraten und müssen während der Entwicklung optimiert werden.
- Umweltfaktoren (Temperatur, Feuchtigkeit) und patientenspezifische Variablen (Hautzustand, Alter) wirken sich auf die Wirksamkeit aus und müssen unter realistischen Bedingungen getestet werden.
- Die Pflaster müssen ein Gleichgewicht zwischen Medikamentenabgabe und Komfort herstellen und Hautreizungen oder allergische Reaktionen minimieren.
-
Sicherheits- und Gebrauchshinweise
- Die Etikettierung muss vor Risiken wie Hautreizungen, Wärmeeinwirkung (z. B. Heizkissen) und Wechselwirkungen mit Substanzen wie Alkohol warnen.
- Für bestimmte Bevölkerungsgruppen (schwangere/stillende Personen, Personen mit Psychosen) können Kontraindikationen erforderlich sein.
- Die Verwendungsrichtlinien (z. B. Ersatz alle 72 Stunden, Tapering-Protokolle) müssen den Patienten klar mitgeteilt werden.
-
Klinische und Post-Market-Anforderungen
- Bioverfügbarkeitsstudien vergleichen die transdermale Verabreichung mit anderen Verabreichungswegen (z. B. oral), um Gleichwertigkeit oder Überlegenheit festzustellen.
- Die Überwachung nach der Markteinführung kontrolliert die Sicherheit in der Praxis, gewährleistet die langfristige Einhaltung der Vorschriften und befasst sich mit unvorhergesehenen unerwünschten Wirkungen.
Wenn diese Bereiche berücksichtigt werden, können die Entwickler die regulatorischen Hürden umgehen und gleichzeitig wirksame, patientenfreundliche transdermale Therapien anbieten.Haben Sie schon darüber nachgedacht, wie sich Pflaster-Klebstoffe weiterentwickeln könnten, um Hautreizungen zu reduzieren, ohne die Medikamentenabgabe zu beeinträchtigen?
Zusammenfassende Tabelle:
| Wichtige regulatorische Erwägungen | Einzelheiten |
|---|---|
| Regulatorische Pfade | NDA für neue Arzneimittel; 505(b)(2) für Neuformulierungen.Erfordert klinische Versuche und Bioverfügbarkeitsstudien. |
| CMC & GMP-Einhaltung | Stabilität der Formulierung, skalierbare Herstellung und analytische Tests (Wirkstofffreisetzung, Haftung). |
| Faktoren für das Pflasterdesign | Optimierung der Arzneimitteleigenschaften (Größe, Lipophilie), Umgebungs-/Patientenvariablen und Hautreizungsrisiken. |
| Sicherheit & Kennzeichnung | Warnung vor Hitzeeinwirkung, Wechselwirkungen mit Alkohol und Kontraindikationen für Risikopopulationen. |
| Überwachung nach der Markteinführung | Überwachen Sie die reale Sicherheit und langfristige Wirksamkeit nach der Zulassung. |
Benötigen Sie fachkundige Beratung bei der Entwicklung transdermaler Pflaster? Partnerschaft mit Enokon Enokon ist ein vertrauenswürdiger Bulk-Hersteller von zuverlässigen transdermalen Pflastern und Schmerzpflastern für Marken und Vertreiber im Gesundheitswesen.Unser technisches Fachwissen gewährleistet die nahtlose Einhaltung von CMC-, GMP- und klinischen Testanforderungen, während unsere kundenspezifischen F&E-Lösungen die Medikamentenabgabe und die Patientensicherheit optimieren. Kontaktieren Sie uns noch heute um Ihr Projekt zu besprechen!
Visuelle Anleitung
Ähnliche Produkte
- Ferninfrarot-Wärmepflaster zur Schmerzlinderung Transdermale Pflaster
- Wärmepflaster zur Schmerzlinderung bei Menstruationskrämpfen
- Herbal Eye Protection Patch Augenpflaster
- Menthol Gel Schmerzlinderungspflaster
- Icy Hot Menthol Medizin Schmerzlinderung Patch
Andere fragen auch
- Wie wirken Wärmepflaster zur Schmerzlinderung?Gezielte Wärmetherapie für dauerhaften Komfort
- Was sind die Hauptmerkmale des Deep Heat Pain Relief Back Patch?Arzneimittelfreie, lang anhaltende Linderung
- Was sind die häufigsten Nebenwirkungen bei der Verwendung von Wärmepflastern mit Medikamenten?Verständnis der Risiken und sichere Anwendung
- Sind Wärmepflaster für alle Körperteile sicher?Wichtige Richtlinien für die sichere Anwendung
- Wie schnell wird das Deep Heat Pain Relief Back Patch aktiviert und wie lange hält die Wärme an?Schnelle & langanhaltende Linderung

















