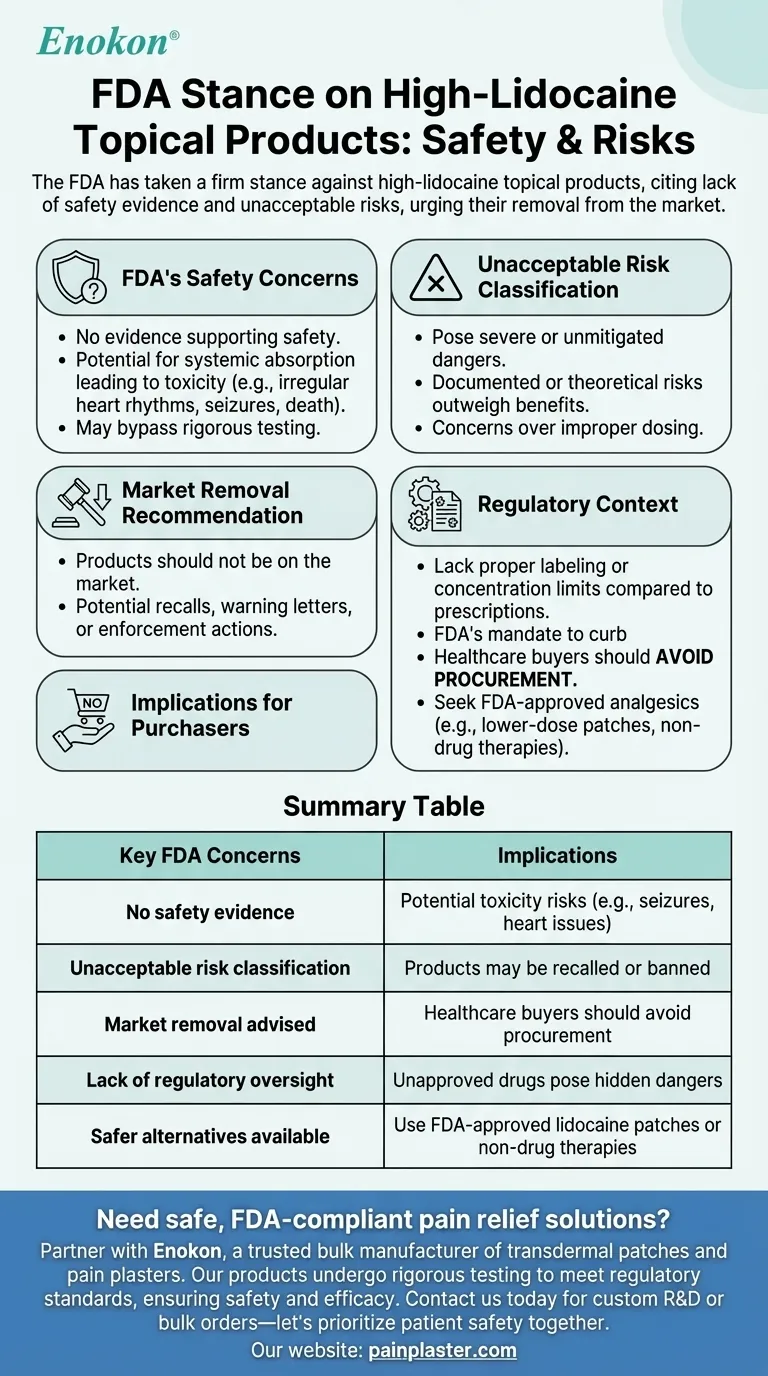
Die FDA hat eine entschiedene Haltung gegen topische Produkte mit hohem Lidocain-Gehalt eingenommen, da es keine Beweise für ihre Sicherheit gibt und sie für die Verbraucher unannehmbare Risiken darstellen.Die Behörde erklärt ausdrücklich, dass diese Produkte aufgrund möglicher Gesundheitsrisiken nicht auf dem Markt erhältlich sein sollten.Diese Position spiegelt die Besorgnis über ungeprüfte Sicherheitsaussagen und das Potenzial für Missbrauch oder schädliche Auswirkungen wider und unterstreicht die Notwendigkeit einer strengeren behördlichen Aufsicht zum Schutz der öffentlichen Gesundheit.

Die wichtigsten Punkte werden erklärt:
-
Die Sicherheitsbedenken der FDA
- Die FDA hat keine Beweise die die Sicherheit von topischen Produkten mit hohem Lidocainanteil belegen.
- Dieser Mangel an Daten gibt Anlass zu Bedenken hinsichtlich potenzieller Risiken wie der systemischen Absorption, die zu Toxizität führen kann (z. B. Herzrhythmusstörungen, Krampfanfälle oder in extremen Fällen sogar zum Tod).
- Die Haltung der Behörde impliziert, dass diese Produkte die strengen Tests, die für zugelassene Medikamente vorgeschrieben sind, umgehen könnten, was die Unsicherheit über ihre Wirkung erhöht.
-
Einstufung als inakzeptables Risiko
- Die FDA stuft diese Produkte wie folgt ein unannehmbare Risiken Eine seltene Bezeichnung, die für Produkte mit schwerwiegenden oder unüberwindbaren Gefahren reserviert ist.
- Dies deutet darauf hin, dass dokumentierte unerwünschte Ereignisse oder theoretische Risiken (z. B. unsachgemäße Dosierung aufgrund mangelnder Standardisierung) die wahrgenommenen Vorteile überwiegen.
-
Empfehlung zur Marktrücknahme
- Die Behauptung, dass diese Produkte nicht auf dem Markt sein sollten unterstreicht den proaktiven Ansatz der FDA beim Verbraucherschutz.
- Dies kann Rückrufe, Warnschreiben an Hersteller oder Durchsetzungsmaßnahmen gegen Händler zur Folge haben.
-
Regulatorischer Kontext
- Im Gegensatz zu verschreibungspflichtigem Lidocain (für das es Dosierungskontrollen und eine klinische Überwachung gibt) fehlen bei frei verkäuflichen Produkten mit hohem Lidocain-Gehalt möglicherweise eine ordnungsgemäße Kennzeichnung oder Konzentrationsgrenzen.
- Die Position der FDA entspricht ihrem Auftrag, nicht zugelassene Arzneimittel, die sich als topische Heilmittel ausgeben, zu unterbinden.
-
Implikationen für Einkäufer
- Einkäufer im Gesundheitswesen sollten Beschaffung vermeiden derartige Produkte zu vermeiden, bis weitere Erkenntnisse oder eine neue Formulierung die Bedenken der FDA ausräumen.
- Alternative, von der FDA zugelassene Analgetika (z. B. Lidocain-Pflaster in niedrigerer Dosierung oder nichtmedikamentöse Therapien) können ein sicherer Ersatz sein.
Die Warnung der FDA dient als kritische Erinnerung an die versteckten Gefahren in scheinbar harmlosen OTC-Produkten und fordert sowohl Verbraucher als auch Fachleute auf, überprüften Sicherheitsdaten den Vorzug vor anekdotischen Behauptungen zu geben.
Zusammenfassende Tabelle:
| Wichtigste FDA-Bedenken | Implikationen |
|---|---|
| Kein Nachweis der Sicherheit | Mögliche Toxizitätsrisiken (z. B. Krampfanfälle, Herzprobleme) |
| Einstufung als inakzeptables Risiko | Produkte können zurückgerufen oder verboten werden |
| Marktrücknahme empfohlen | Einkäufer im Gesundheitswesen sollten Beschaffung vermeiden |
| Fehlende behördliche Aufsicht | Nicht zugelassene Medikamente bergen versteckte Gefahren |
| Sicherere Alternativen verfügbar | Verwenden Sie FDA-zugelassene Lidocain-Pflaster oder nicht-medikamentöse Therapien |
Sie benötigen sichere, FDA-konforme Lösungen zur Schmerzlinderung? Partnerschaft mit Enokon ist ein vertrauenswürdiger Großhersteller von transdermalen Pflastern und Schmerzpflastern für Händler und Marken im Gesundheitswesen.Unsere Produkte werden strengen Tests unterzogen, um die behördlichen Standards zu erfüllen und Sicherheit und Wirksamkeit zu gewährleisten. Kontaktieren Sie uns noch heute für kundenspezifische F&E oder Großbestellungen - lassen Sie uns gemeinsam die Patientensicherheit in den Vordergrund stellen.
Visuelle Anleitung
Ähnliche Produkte
- Lidocain-Hydrogel-Pflaster zur Schmerzlinderung
- Capsaicin-Chili-Pflaster zur medizinischen Schmerzlinderung
- Far Infrared Deep Heat Relief Patches Medizinische Schmerzpflaster
- Medizinische kühlende Gel-Pflaster für Fieber Kühlende Pflaster
- Icy Hot Menthol Medizin Schmerzlinderung Patch
Andere fragen auch
- Wozu werden Lidocain-Pflaster verwendet?Gezielte Schmerzlinderung bei chronischen und Nervenschmerzen
- Welche Alternativen gibt es zu Lidocain-Pflastern bei Schmerzen im unteren Rückenbereich?Entdecken Sie wirksame Optionen zur Schmerzlinderung
- Was sind die möglichen Nebenwirkungen von Lidocain-Pflastern?Risiken verstehen für sichere Schmerzlinderung
- Was sind Lidocain-Pflaster und wie funktionieren sie?Gezielte Schmerzlinderung erklärt
- Wie sollten Lidocain-Pflaster sicher angewendet werden?Wichtige Schritte für eine wirksame Schmerzlinderung
















