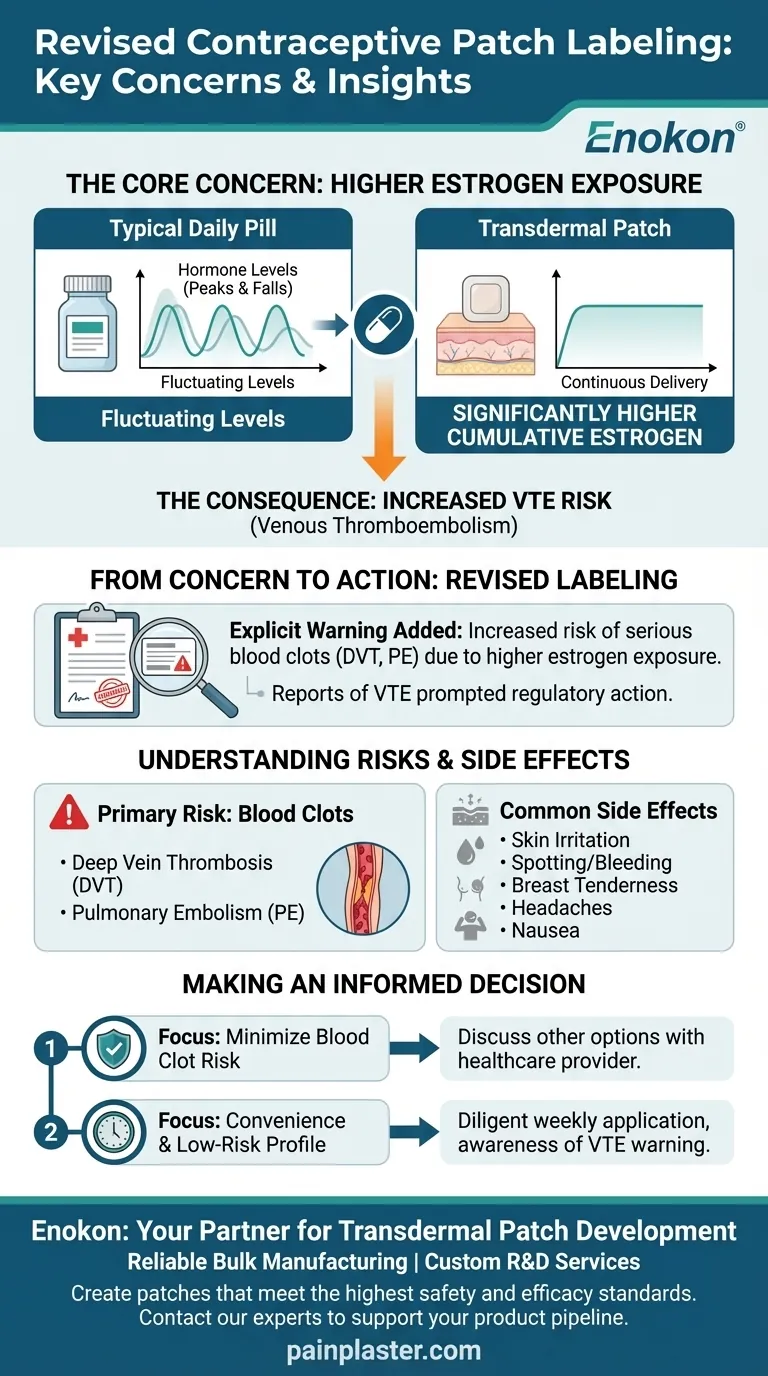
Die überarbeitete Kennzeichnung des Verhütungspflasters wurde in erster Linie durch die Bedenken über die erhöhte Östrogenexposition und die damit verbundenen Risiken, insbesondere venöse Thromboembolien (VTE), ausgelöst.Studien wiesen darauf hin, dass das Pflaster höhere systemische Östrogenspiegel als orale Verhütungsmittel liefert, was die Aufsichtsbehörden dazu veranlasste, die Warnhinweise zu aktualisieren.Weitere Faktoren waren Berichte über Hautreizungen und eine geringere Wirksamkeit aufgrund einer uneinheitlichen Anwendung.Diese Erkenntnisse führten zu einer klareren Risikokommunikation auf den Etiketten, um Anwender und Gesundheitsdienstleister besser zu informieren.

Die wichtigsten Punkte werden erklärt:
-
Erhöhte Östrogenexposition
- Das Estradiol td-Pflaster wurde festgestellt, dass im Vergleich zu niedrig dosierten oralen Verhütungsmitteln bis zu 60 % mehr Östrogen in den Blutkreislauf gelangt.
- Die höhere systemische Absorption führte zu Bedenken hinsichtlich der kumulativen Exposition, insbesondere bei wöchentlicher Anwendung.
-
Erhöhtes Risiko für venöse Thromboembolien (VTE)
- Klinische Daten brachten die höheren Östrogenspiegel des Pflasters mit einem 1,5-2-fach höheren VTE-Risiko in Verbindung als bei oralen Kontrazeptiva.
- In der überarbeiteten Kennzeichnung wird nun ausdrücklich vor diesem Risiko gewarnt, insbesondere bei Anwenderinnen mit prädisponierenden Faktoren (z. B. Übergewicht, Rauchen).
-
Bedenken hinsichtlich der Wirksamkeit in der Praxis
- Im Gegensatz zu den täglichen Pillen muss das Pflaster wöchentlich gewechselt werden, und wenn es nicht gewechselt wird, verringert sich seine Wirksamkeit.
- Auf den Etiketten wird jetzt die Einhaltung der Vorschriften betont, um ungewollte Schwangerschaften zu vermeiden.
-
Häufige Nebenwirkungen
- Häufig wurde über Hautreizungen an der Applikationsstelle berichtet, was zu einer klareren Anleitung zur Rotation und Platzierung führte.
- Andere festgestellte Wirkungen (z. B. Brustspannen, Übelkeit) wurden in die Kennzeichnung aufgenommen, um die Erwartungen der Anwender zu erfüllen.
-
Regulatorische und klinische Reaktion
- Daten aus der Marktüberwachung waren Mitte der 2000er Jahre der Auslöser für die von der FDA vorgeschriebene Aktualisierung der Etikettierung.
- Gesundheitsdienstleistern wird empfohlen, Risiken und Nutzen abzuwägen, insbesondere bei Risikopatientinnen.
Diese Überarbeitungen spiegeln eine breitere Verlagerung hin zu mehr Transparenz bei der Sicherheit von Verhütungsmitteln wider, die ein Gleichgewicht zwischen Wirksamkeit und informierter Wahl ermöglicht.Für die Anwenderinnen bedeutet das Verständnis dieser Nuancen eine sicherere und effektivere Familienplanung.
Zusammenfassende Tabelle:
| Besorgnis | Auswirkungen | Update der Kennzeichnung |
|---|---|---|
| Erhöhte Östrogenexposition | 60% höhere systemische Absorption im Vergleich zu oralen Kontrazeptiva | Deutlichere Warnhinweise zur kumulativen Östrogenexposition |
| VTE-Risiko | 1,5-2-fach höheres Risiko als bei Tabletten | Explizite VTE-Warnungen für Hochrisikopatienten (z. B. Raucher, fettleibige Patienten) |
| Fragen der Therapietreue | Versäumte wöchentliche Wechsel verringern die Wirksamkeit | Hervorgehobene Einnahmeanweisungen zur Vermeidung ungewollter Schwangerschaften |
| Hautreizung | Häufige Reaktionen an der Stelle | Zusätzliche Hinweise zur Rotation/Platzierung zur Minimierung von Reizungen |
| Regulatorische Reaktion | Von der FDA vorgeschriebene Aktualisierungen der Daten nach der Markteinführung | Gesundheitsdienstleistern wird empfohlen, individuelle Nutzen-Risiko-Profile zu bewerten |
Benötigen Sie zuverlässige transdermale Lösungen mit ausgewogenen Sicherheitsprofilen? Partner mit Enokon ist ein zuverlässiger Hersteller von FDA-konformen Verhütungspflastern und Schmerzpflastern in großen Mengen.Unser Know-how in der kundenspezifischen Forschung und Entwicklung gewährleistet optimierte Formulierungen für Wirksamkeit und Anwendersicherheit. Kontaktieren Sie unser Team um maßgeschneiderte Lösungen für Ihre Marke im Gesundheitswesen oder Ihren Vertriebsbedarf zu besprechen.
Visuelle Anleitung
Ähnliche Produkte
- Prostata-Schmerz-Nieren-Gesundheitspflaster für Männer
- Capsaicin-Chili-Pflaster zur medizinischen Schmerzlinderung
- Far Infrared Deep Heat Relief Patches Medizinische Schmerzpflaster
- Lidocain-Hydrogel-Pflaster zur Schmerzlinderung
- Icy Hot Menthol Medizin Schmerzlinderung Patch
Andere fragen auch
- Gibt es besondere Vorsichtsmaßnahmen für Sportler, die Testosteronpflaster verwenden?Wichtige Richtlinien für eine sichere und vorschriftsmäßige Anwendung
- Können Testosteronpflaster während der sexuellen Aktivität verwendet werden?Leitfaden zur Sicherheit und Exposition des Partners
- Wie verhalten sich Testosteronpflaster und -injektionen in Bezug auf die Stabilität des Hormonspiegels?
- Wie sollten Testosteronpflaster aufbewahrt werden?Bewährte Praktiken für optimale Effektivität
- Wie funktioniert ein Testosteronpflaster?Stetige Hormonabgabe für bessere Ergebnisse















