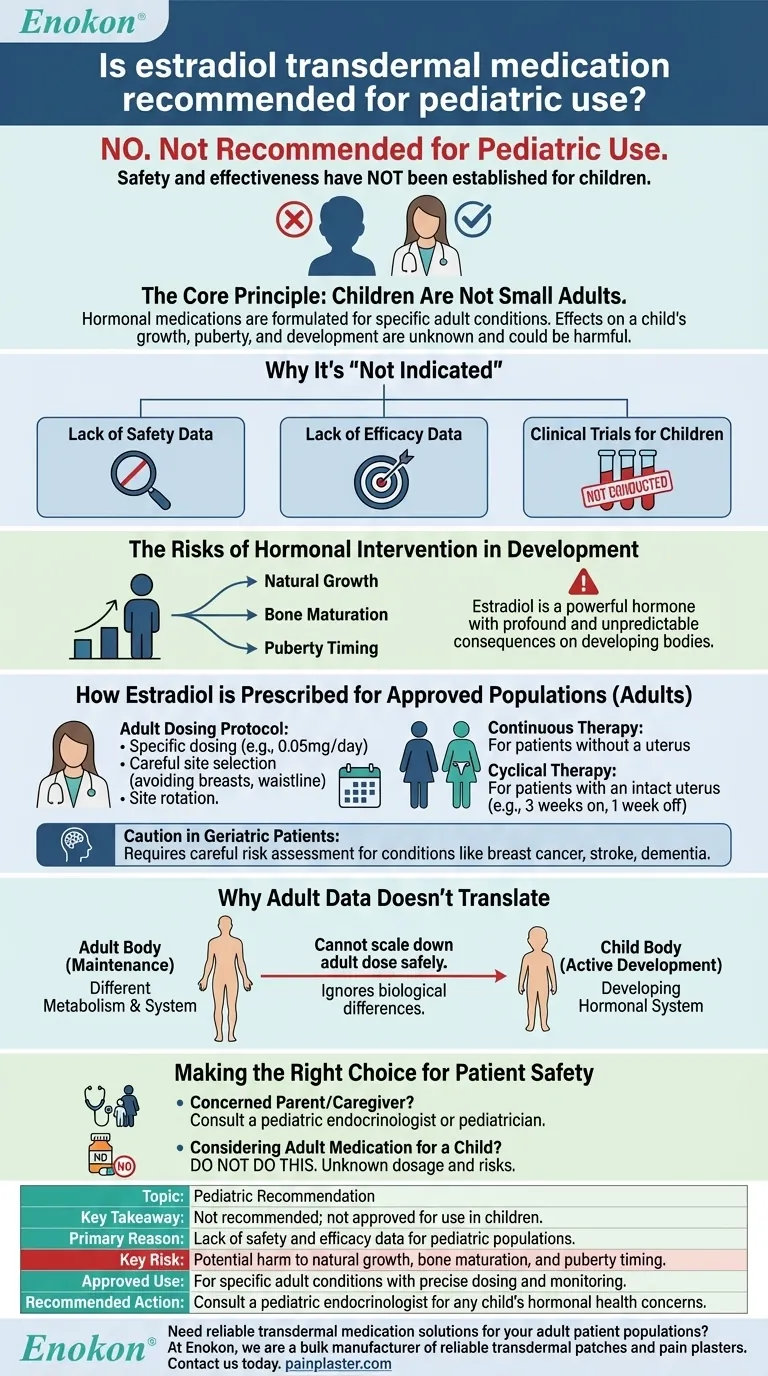
Die Verwendung von Estradiol Transdermales Pflaster , Gel oder Spray wird derzeit nicht für pädiatrische Patientinnen empfohlen, da es keine gesicherten Daten zur Sicherheit und Wirksamkeit gibt.Regulatorische Richtlinien und klinische Nachweise unterstützen die Anwendung bei Kindern nicht, da die Risiken - einschließlich möglicher hormoneller und entwicklungsbezogener Auswirkungen - in dieser Bevölkerungsgruppe noch nicht untersucht wurden.Alternative Behandlungen mit nachgewiesenen pädiatrischen Sicherheitsprofilen sollten unter ärztlicher Aufsicht in Betracht gezogen werden.

Die wichtigsten Punkte werden erklärt:
-
Fehlende pädiatrische Indikation
- Die transdermalen Estradiol-Formulierungen (Pflaster, Gel, Spray) sind für Kinder weder von der FDA zugelassen noch klinisch validiert.
- Da es keine kontrollierten Studien gibt, sind mögliche Nebenwirkungen (z. B. hormonelle Störungen, Wachstumsstörungen) nicht bekannt.
-
Bedenken hinsichtlich der Sicherheit und Wirksamkeit
- Die pädiatrische Physiologie (z. B. Stoffwechselraten, Hautresorption) unterscheidet sich von der Erwachsener, was zu einer unvorhersehbaren Reaktion auf das Medikament führt.
- Bei analogen transdermalen Medikamenten (z. B. Selegilin) wurden bei jüngeren Patienten Risiken wie Selbstmordgedanken festgestellt, was die Notwendigkeit von Vorsicht unterstreicht.
-
Regulatorische und klinische Leitlinien
- Die derzeitige Kennzeichnung besagt ausdrücklich, dass diese Produkte nicht für die pädiatrische Verwendung indiziert sind.
- Eine Off-Label-Verwendung ohne stichhaltige Beweise könnte Kinder unnötigen Risiken aussetzen.
-
Alternative Ansätze
- Bei Erkrankungen, die eine Östrogentherapie erfordern (z. B. bei verzögerter Pubertät), entscheiden sich pädiatrische Endokrinologen in der Regel für orale oder injizierbare Formen mit etablierten Dosierungsprotokollen.
- Eine genaue Überwachung ist unerlässlich, um den therapeutischen Nutzen gegen die Auswirkungen auf die Entwicklung abzuwägen.
Die transdermale Verabreichung ist zwar bequem, aber ihre Anwendung in der Pädiatrie erfordert strenge Forschung.Solange solche Daten nicht vorliegen, sollten Kliniker Therapien mit dokumentierten Sicherheitsprofilen für jüngere Patienten den Vorzug geben.
Zusammenfassende Tabelle:
| Hauptanliegen | Erläuterung |
|---|---|
| Fehlende pädiatrische Indikation | Keine FDA-Zulassung für Kinder; keine kontrollierten Studien zur Sicherheit oder Wirksamkeit. |
| Sicherheitsrisiken | Mögliche hormonelle Störungen, Wachstumsstörungen und unvorhersehbare Absorption. |
| Regulatorische Leitlinien | Die Kennzeichnung schließt die Verwendung in der Pädiatrie aufgrund von nicht untersuchten Risiken ausdrücklich aus. |
| Alternativen | Orale oder injizierbare Östrogentherapien mit bewährter pädiatrischer Dosierung. |
Für fachkundige Beratung zu pädiatrischen Hormontherapielösungen, kontaktieren Sie Enokon noch heute .Als vertrauenswürdiger Hersteller von transdermalen Pflastern und Schmerzpflastern sind wir auf kundenspezifische Forschung und Entwicklung für Pharmahändler und Marken im Gesundheitswesen spezialisiert.Wir helfen Ihnen bei der Entwicklung sicherer, wirksamer Lösungen, die auf Ihre Bedürfnisse zugeschnitten sind.
Visuelle Anleitung
Ähnliche Produkte
- Ferninfrarot-Wärmepflaster zur Schmerzlinderung Transdermale Pflaster
- Far Infrared Deep Heat Relief Patches Medizinische Schmerzpflaster
- Capsaicin-Chili-Pflaster zur medizinischen Schmerzlinderung
- Wärmepflaster zur Schmerzlinderung bei Menstruationskrämpfen
- Far Infrared Pain Patch Relief Schmerzmittel für Rücken
Andere fragen auch
- Wie wirken Wärmepflaster zur Schmerzlinderung?Gezielte Wärmetherapie für dauerhaften Komfort
- Wie funktioniert das Deep Heat Pain Relief Back Patch?Arzneimittelfreie Schmerzlinderung mit therapeutischer Wärme
- Was sind die Hauptmerkmale des Deep Heat Pain Relief Back Patch?Arzneimittelfreie, lang anhaltende Linderung
- Was sind die häufigsten Nebenwirkungen bei der Verwendung von Wärmepflastern mit Medikamenten?Verständnis der Risiken und sichere Anwendung
- Können Wärmepflaster bei frischen Verletzungen verwendet werden?Warum Kältetherapie besser wirkt
















