Die Toxizität von transdermalen Pflastern wird durch eine Kombination aus präklinischen Studien zur Hautreizung, prädiktiver Modellierung und Überwachung nach der Markteinführung überwacht.Zu den primären Methoden gehören der Primary Irritation Index (PII)-Test zur Bewertung lokaler Hautreaktionen wie Erytheme und Ödeme sowie Computermodelle zur Analyse der Wechselwirkungen zwischen Medikament und Haut.Ordnungsgemäße Entsorgungsprotokolle sind entscheidend, um sekundäre Expositionsrisiken zu vermeiden.Diese mehrschichtigen Ansätze gewährleisten die Sicherheit von der Entwicklung bis zur praktischen Anwendung.
Die wichtigsten Punkte erklärt:
-
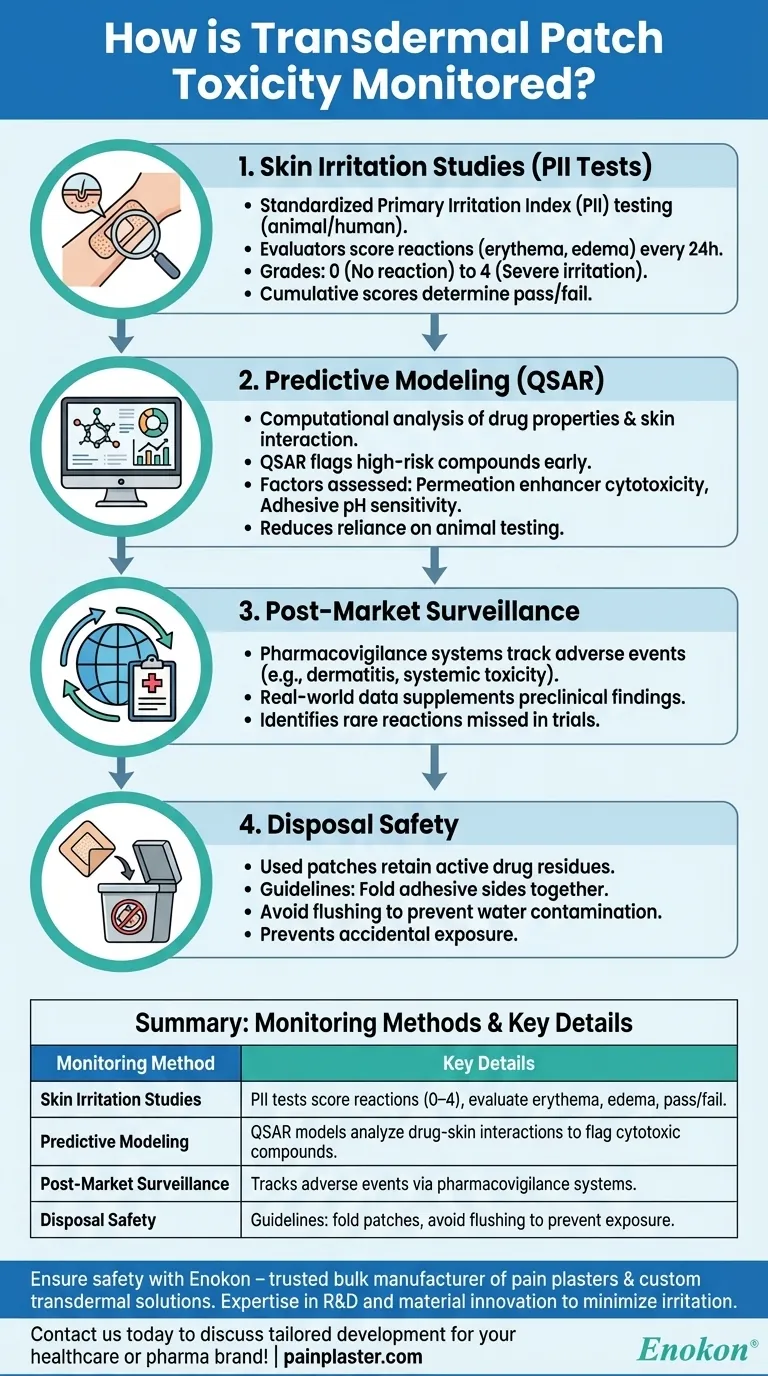
Studien zur Hautreizung (PII-Tests)
- Das transdermale Pflaster wird einem standardisierten PII-Test (Primary Irritation Index) unterzogen, bei dem die Pflaster unter kontrollierten Bedingungen auf die Haut von Tieren oder Menschen aufgetragen werden.
-
Die Prüfer bewerten die Reaktionen (Rötungen, Schwellungen) in Abständen von 24 Stunden mit Noten:
- 0 (keine Reaktion) bis 4 (starke Reizung).
- Die kumulativen Punktzahlen bestimmen die Schwellenwerte für die weitere Entwicklung (bestanden/nicht bestanden).
-
Prädiktive Modellierung
- Computergestützte Werkzeuge analysieren die Eigenschaften von Arzneimitteln (z. B. Löslichkeit, Molekulargewicht) und ihre Wechselwirkung mit Hautschichten.
- Modelle wie QSAR (Quantitative Structure-Activity Relationship) weisen frühzeitig auf risikoreiche Verbindungen hin und verringern die Abhängigkeit von Tierversuchen.
-
Bewertete Faktoren:
- Zytotoxizität der chemischen Permeationsverstärker.
- pH-Empfindlichkeit von Klebeschichten.
-
Post-Market-Überwachung
- Pharmakovigilanzsysteme verfolgen unerwünschte Ereignisse (z. B. Kontaktdermatitis, systemische Toxizität), die von Gesundheitsdienstleistern oder Patienten gemeldet werden.
- Daten aus der realen Welt ergänzen die präklinischen Ergebnisse und zeigen seltene Reaktionen auf, die in Studien übersehen wurden.
-
Sicherheit bei der Entsorgung
- Gebrauchte Pflaster enthalten Wirkstoffrückstände; bei unsachgemäßer Entsorgung besteht die Gefahr einer versehentlichen Exposition (z. B. durch Kinder/Haustiere).
-
Richtlinien umfassen:
- Falten Sie die Klebeseiten vor der Entsorgung zusammen.
- Vermeiden von Spülungen zur Vermeidung von Wasserkontaminationen.
-
Aufstrebende Technologien
- Mikronadel-Arrays und biologisch abbaubare Materialien sollen das Risiko von Irritationen verringern und gleichzeitig die Präzision der Medikamentenabgabe verbessern.
Durch die Integration dieser Strategien können die Hersteller ein Gleichgewicht zwischen Wirksamkeit und Patientensicherheit herstellen und so sicherstellen, dass die Pflaster die behördlichen Vorschriften erfüllen und gleichzeitig möglichst wenig Schaden anrichten.Haben Sie darüber nachgedacht, wie Materialinnovationen die Reizung bei zukünftigen Designs weiter reduzieren könnten?
Zusammenfassende Tabelle:
| Überwachungsmethode | Wichtige Details |
|---|---|
| Studien zur Hautreizung | PII-Tests bewerten Reaktionen (0-4), um Erytheme, Ödeme und Pass/Fail-Schwellenwerte zu beurteilen. |
| Prädiktive Modellierung | QSAR-Modelle analysieren die Wechselwirkungen zwischen Medikamenten und Haut, um zytotoxische Verbindungen frühzeitig zu erkennen. |
| Post-Market-Überwachung | Verfolgt unerwünschte Ereignisse (z. B. Dermatitis) über Pharmakovigilanzsysteme. |
| Sicherheit bei der Entsorgung | Zu den Richtlinien gehören das Falten der Pflaster und das Vermeiden von Spülvorgängen, um eine Exposition zu vermeiden. |
Stellen Sie sicher, dass Ihre transdermalen Pflaster die Sicherheitsstandards erfüllen mit Enokon -Ihr vertrauenswürdiger Hersteller von zuverlässigen Schmerzpflastern und maßgeschneiderten transdermalen Lösungen.Unser Know-how in den Bereichen Forschung und Entwicklung sowie Materialinnovation trägt dazu bei, das Risiko von Irritationen zu minimieren und gleichzeitig die Wirksamkeit zu maximieren. Kontaktieren Sie uns noch heute um eine maßgeschneiderte Entwicklung für Ihre Gesundheits- oder Pharmamarke zu besprechen!
Visuelle Anleitung
Ähnliche Produkte
- Ferninfrarot-Wärmepflaster zur Schmerzlinderung Transdermale Pflaster
- Wärmepflaster zur Schmerzlinderung bei Menstruationskrämpfen
- Herbal Eye Protection Patch Augenpflaster
- Icy Hot Menthol Medizin Schmerzlinderung Patch
- Menthol Gel Schmerzlinderungspflaster
Andere fragen auch
- Was sind die Hauptmerkmale des Deep Heat Pain Relief Back Patch?Arzneimittelfreie, lang anhaltende Linderung
- Sind Wärmepflaster für alle Körperteile sicher?Wichtige Richtlinien für die sichere Anwendung
- Wie funktioniert das Deep Heat Pain Relief Back Patch?Arzneimittelfreie Schmerzlinderung mit therapeutischer Wärme
- Wie schnell wird das Deep Heat Pain Relief Back Patch aktiviert und wie lange hält die Wärme an?Schnelle & langanhaltende Linderung
- Können Wärmepflaster bei frischen Verletzungen verwendet werden?Warum Kältetherapie besser wirkt












