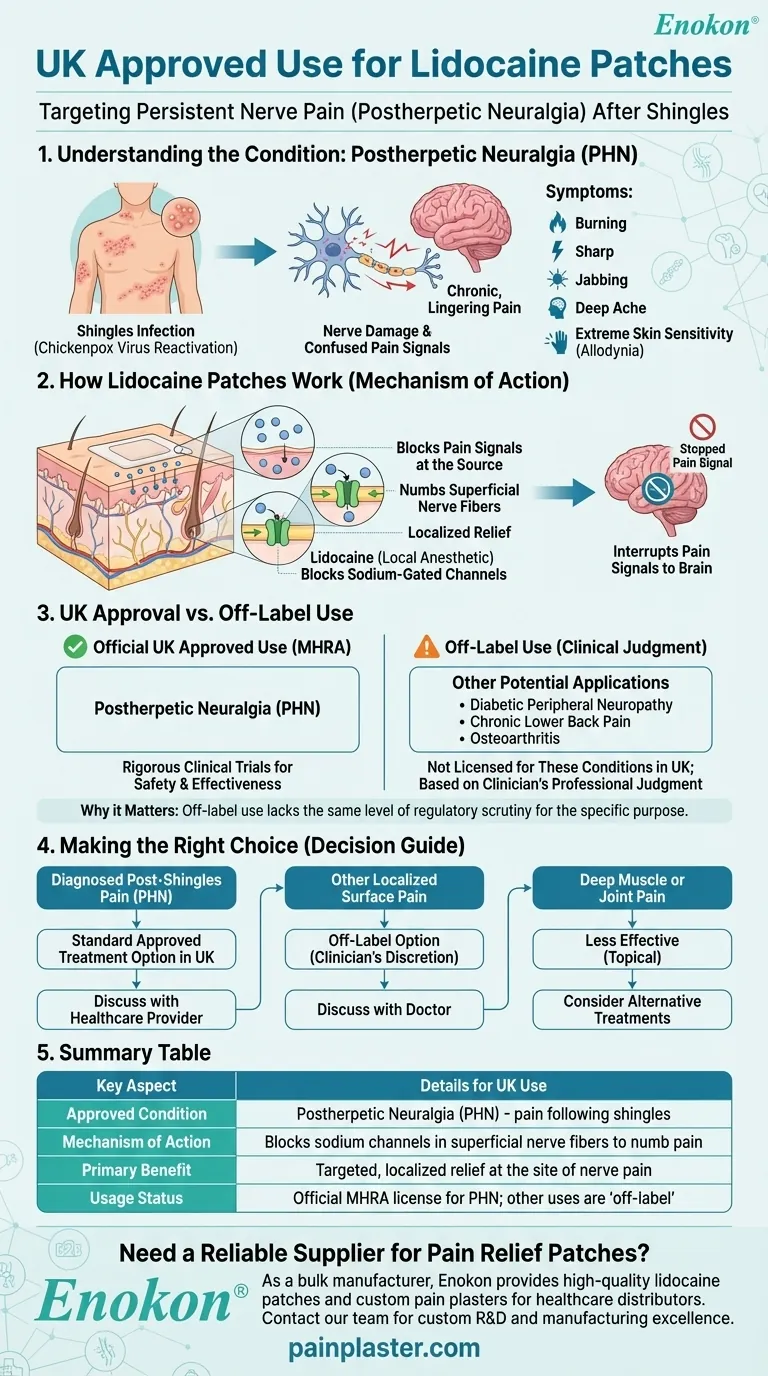
Im Vereinigten Königreich, Lidocain-Pflaster sind speziell für die Behandlung der postherpetischen Neuralgie (PHN) zugelassen, einem anhaltenden Nervenschmerz, der nach einer Gürtelrose-Infektion auftreten kann.Die Forschung deutet zwar auf eine mögliche Off-Label-Verwendung für andere Schmerzzustände hin, aber die britische Zulassung ist eng auf die Behandlung von PHN ausgerichtet.Dies unterscheidet sich geringfügig von den umfassenderen FDA-Zulassungen und spiegelt die regionalen regulatorischen Unterschiede in der Schmerzbehandlung wider.

Die wichtigsten Punkte erklärt:
-
Primäre zugelassene Indikation im Vereinigten Königreich
- Lidocain-Pflaster sind im Vereinigten Königreich ausschließlich zur Behandlung der postherpetischen Neuralgie (PHN) zugelassen.
- PHN ist ein neuropathisches Schmerzsyndrom nach einer Gürtelrose (Herpes-Zoster-Infektion), das durch anhaltende Schmerzen in den zuvor betroffenen Hautbereichen gekennzeichnet ist.
-
Wirkmechanismus bei PHN
- Die Pflaster geben lokal Lidocain (5%ige Konzentration) ab, um abnormale Nervensignale in geschädigten peripheren Nerven zu blockieren.
- Durch die topische Anwendung wird die systemische Absorption minimiert, was die Nebenwirkungen im Vergleich zu oralen Analgetika reduziert.
-
Regulatorischer Kontext
- Die britische Zulassung entspricht dem Rahmen der Europäischen Arzneimittelagentur (EMA), die in der Regel solide klinische Nachweise für bestimmte Indikationen verlangt.
- Im Gegensatz zur FDA haben die britischen und EU-Behörden die Zulassung trotz neuer Forschungsergebnisse nicht auf andere neuropathische Schmerzzustände (z. B. diabetische Neuropathie) ausgeweitet.
-
Klinische Erwägungen
- Die Pflaster werden bis zu 12 Stunden/Tag direkt auf die intakte Haut der schmerzenden Stellen geklebt.
- Zu den Kontraindikationen gehören Überempfindlichkeit gegen Lidocain oder die Bestandteile des Pflasters.
-
Potenzielle Off-Label-Verwendung
- Obwohl im Vereinigten Königreich nicht zugelassen, belegen Studien die Wirksamkeit bei Osteoarthritis, chronischen Rückenschmerzen und Schmerzen nach Operationen.
- Verordner können den Off-Label-Einsatz auf der Grundlage der individuellen Patientenbedürfnisse und der Risiko-Nutzen-Bewertung in Betracht ziehen.
-
Implikationen für den Einkauf
- Bei der Beschaffung im Gesundheitswesen sollten überprüfte und im Vereinigten Königreich zugelassene Formulierungen für die Behandlung von PHN bevorzugt werden.
- Für Forschungszwecke oder erweiterte Anwendungen können institutionelle Protokolle zusätzliche Begründungen erfordern.
Die angestrebte Zulassung im Vereinigten Königreich spiegelt einen vorsichtigen Ansatz bei der Behandlung neuropathischer Schmerzen wider, der den Schwerpunkt auf den evidenzbasierten Einsatz bei PHN legt und gleichzeitig ein breiteres therapeutisches Potenzial durch laufende Forschung anerkennt.
Zusammenfassende Tabelle:
| Hauptaspekt | Einzelheiten |
|---|---|
| Zugelassener Zustand | Nur postherpetische Neuralgie (PHN) |
| Wirkmechanismus | Örtliche Verabreichung von 5%igem Lidocain zur Blockierung abnormaler Nervensignale |
| Anwendungsrichtlinien | Auf intakte Haut für ≤12 Stunden/Tag auftragen; überempfindliche Bereiche vermeiden |
| Regulatorischer Umfang | EMA-konforme Zulassung (keine Erweiterung für andere neuropathische Schmerzzustände im Vereinigten Königreich) |
| Off-Label-Potenzial | Osteoarthritis, chronische Rückenschmerzen (liegt im Ermessen des Arztes) |
Benötigen Sie zuverlässige Lidocain-Pflaster zur Behandlung von PHN? Als vertrauenswürdiger Hersteller von transdermalen Lösungen zur Schmerzlinderung, Enokon bietet:
- UK-konforme Formulierungen für die Behandlung der postherpetischen Neuralgie
- Kundenspezifische F&E-Unterstützung für Vertriebshändler und Marken im Gesundheitswesen
- GMP-zertifizierte Produktion für gleichbleibende Qualität und Wirksamkeit
Kontaktieren Sie unser Team um Ihren Beschaffungs- oder Entwicklungsbedarf noch heute zu besprechen!
Visuelle Anleitung
Ähnliche Produkte
- Lidocain-Hydrogel-Pflaster zur Schmerzlinderung
- Capsaicin-Chili-Pflaster zur medizinischen Schmerzlinderung
- Far Infrared Deep Heat Relief Patches Medizinische Schmerzpflaster
- Asthma-Husten- und Schmerzlinderungspflaster für Erwachsene und Kinder
- Wärmepflaster zur Schmerzlinderung bei Menstruationskrämpfen
Andere fragen auch
- Welche lokalen Hautreaktionen können durch Lidocainpflaster verursacht werden?Umgang mit Irritationen und Allergien
- Was sind Lidocain-Pflaster und wie funktionieren sie?Gezielte Schmerzlinderung erklärt
- Gibt es stichhaltige Beweise für die Wirksamkeit von Lidocain-Pflastern bei Rückenschmerzen?
- Welche Alternativen gibt es zu Lidocain-Pflastern bei Schmerzen im unteren Rückenbereich?Entdecken Sie wirksame Optionen zur Schmerzlinderung
- Wie sollte man mit Hautreizungen durch Lidocainpflaster umgehen?Expertentipps für eine sichere und wirksame Anwendung
















